Contexte

Le traitement des infections sur prothèses articulaires repose sur une prise en charge chirurgicale et un traitement antibiotique optimal.
Cette antibiothérapie est complexe car elle nécessite d’utiliser un ou plusieurs antibiotiques, à forte posologie et de manière prolongée (plusieurs mois).
Enjeu

L’émergence et la diffusion des bactéries multi-résistantes (BMR) en France comme à l’étranger, concernant principalement les entérobactéries rend leur traitement encore plus complexe, compte-tenu de la forte prévalence de la résistance aux fluoroquinolones. Pour certains patients, cela peut conduire à des difficultés, voire des impasses thérapeutiques.

Travaux menés
L’objectif des chercheurs est d’identifier les meilleurs traitements possibles en cas d’infection osseuse causée par des bactéries multi-résistantes.
Cette situation étant rare, ils s’appuient sur des modèles animaux chez le lapin, menés dans le respect des règles éthiques, afin de déterminer quel antibiotique ou quelles combinaisons d’antibiotiques permet d’éradiquer les bactéries au niveau de l’os de l’animal infecté.
Mieux comprendre comment fonctionnent les traitements antibiotiques permet aussi de limiter l’apparition de nouvelles résistances aux antibiotiques.
Les chercheurs du groupe de travail

Anne-Claude CREMIEUX

Azzam SALEH-MGHIR

Benjamin DAVIDO

Laure GATIN
Pour aller plus loin
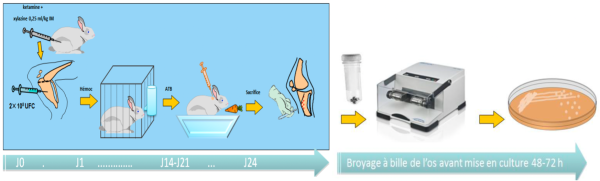
Figure 1. Description schématique du modèle animal utilisé dans ce projet.
Ce modèle expérimental animal permet d’induire une ostéomyélite par des bactéries hautement résistantes émergentes (BHRe) : Klebsiella pneumoniae productrice d’une carbapénémase de type KPC ou Escherichia coli producteur d’une OXA-48 et d’une BLSE. L’objectif était de tester l’efficacité de la combinaison ceftazidime-avibactam (CAZ-AVI), seule ou en association. Les résultats, publiés (1,2), démontrent que les différents antibiotiques testés permettent de réduire la charge bactérienne comparativement au groupe témoin des animaux non traités. Dans les 2 travaux, seule la combinaison d’antibiotique à base de ceftazidime-avibactam ont permis d’obtenir une stérilisation osseuse, en particulier les combinaisons ceftazidime-avibactam + gentamicine ou colistine contre K. pneumoniae ou E. coli (Figure 2 et 3).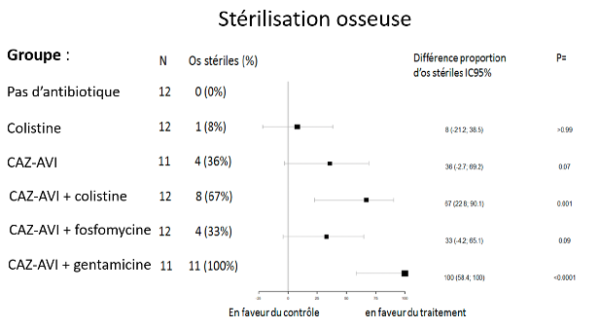
Figure 2 : Résultats expérimentaux obtenus avec le modèle expérimental d’ostéomyélite à K. pneumoniae KPC.
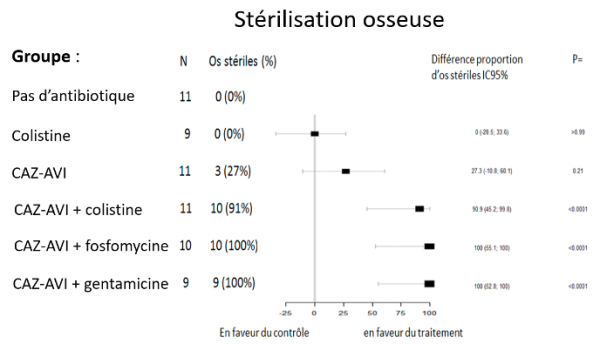
Figure 3 : Modèle expérimental d’ostéomyélite à E. coli OXA-48 et BLSE.
De façon intéressante, dans nos travails précédents utilisant sur la même souche de KPC, il fallait une combinaison à base de 3 antibiotiques (colistine + gentamicine + fosfomycine) pour obtenir la stérilisation osseuse (3). Ces données nous permettent d’étayer la complexité propre à chaque modèle, en fonction de la souche bactérienne impliquée, de la présence ou non de matériel étranger, ainsi que de la molécule utilisée en monothérapie ou en association. Ces données permettent d’aider les cliniciens à choisir la meilleure antibiothérapie adaptée à chaque situation clinique, dans ces situations rares mais potentiellement graves avec un véritable risque d’impasse thérapeutique.RÉFÉRENCES
Davido B, Crémieux AC, Vaugier I, Gatin L, Noussair L, Massias L, Laurent F, Saleh-Mghir A.Int J Antimicrob Agents. 2023 Jan;61(1):106702. doi: 10.1016/j.ijantimicag.2022.106702. Epub 2022 Dec 5.
Davido B, Crémieux AC, Vaugier I, De Truchis P, Hamami K, Laurent F, Saleh-Mghir A.J Antimicrob Chemother. 2023 May 3;78(5):1211-1218. doi: 10.1093/jac/dkad070.
Crémieux AC, Dinh A, Nordmann P, Mouton W, Tattevin P, Ghout I, Jayol A, Aimer O, Gatin L, Verdier MC, Saleh-Mghir A, Laurent F.J Antimicrob Chemother. 2019 Sep 1;74(9):2666-2675. doi: 10.1093/jac/dkz257.





